Sztuczna inteligencja będzie projektować implanty czaszkowe nie tylko równie dobrze jak ludzie, ale znacznie szybciej – planuje dr inż. Marek Wodziński z Wydziału Elektrotechniki, Automatyki, Informatyki i Inżynierii Biomedycznej. Na realizacji projektu mogą zyskać dziesiątki tysięcy osób.
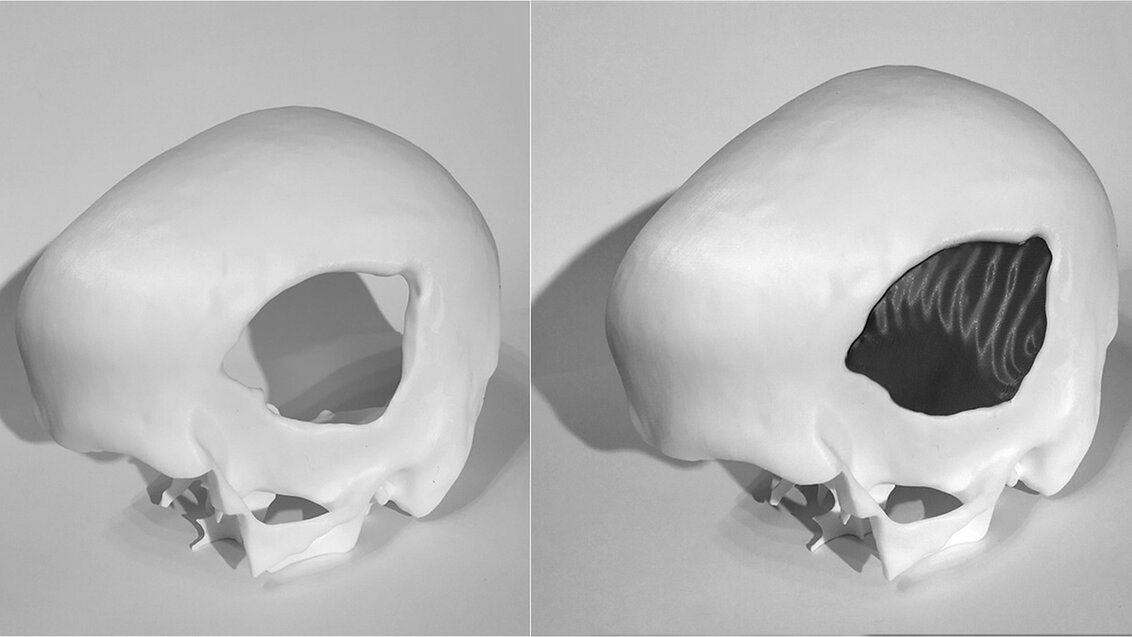
Aby uzupełnić ubytek wystarczy zaprojektować implant, którym będzie można zastąpić kość, później z materiału zaakceptowanego do użytku medycznego stworzyć jego fizyczną formę, a na koniec przeprowadzić zabieg wszczepienia implantu. Medycyna nie przewiduje przeszkód w powodzeniu większości takich operacji – nauka wyposażyła nas już we wszystkie narzędzia niezbędne, by pomóc ludziom z ubytkami kości czaszki.
Mimo to osoby wymagające wszczepienia implantu czaszkowego stanowiły część grupy około 5 milionów pacjentów z całego świata, którzy w 2019 r., pomimo wskazań medycznych, nie przeszli operacji neurochirurgicznej umożliwiającej im pełen powrót do zdrowia. Także w Polsce wiele osób, które, w wyniku interwencji chirurgicznej koniecznej ze względu na doznany uraz lub chorobę nowotworową, zostały pozbawione pełnej ochrony mechanicznej mózgu, są zmuszone czekać na operację wszczepienia implantu całymi miesiącami. W tym czasie miejsca i sytuacje, które dla większości z nas są codziennością, dla nich mogą być śmiertelnym zagrożeniem. Zmagają się też z wykluczeniem społecznym lub niechęcią do kontaktów społecznych, bo przez widoczne deformacje czują się inni. Tak długi czas oczekiwania na operację ma głównie dwie przyczyny – proces wytwarzania zindywidualizowanych implantów czaszkowych jest obecnie bardzo czasochłonny, a liczba neurochirurgów niewystarczająca.
Szybkość wymaga innowacji
Implanty są projektowane przez biomechaników wykwalifikowanych w obsłudze specjalistycznego oprogramowania. Stworzenie modelu implantu optymalnie dopasowanego do powstałego ubytku każdorazowo wymaga indywidualnej analizy danych medycznych pacjenta – może to trwać od kilku do kilkudziesięciu godzin. By projekt przybrał fizyczną formę, zwykle trafia do innej firmy, która zajmuje się produkcją implantu, np. przy użyciu drukarek 3D, a później jeszcze do kolejnej firmy, która zajmuje się jego sterylizacją (jeśli ta nie odbywa się w szpitalu). Cały proces poprzedzający dopuszczenie implantu do wszczepienia pacjentowi wydłuża się do tygodni lub miesięcy.
Naukowiec z AGH dr inż. Marek Wodziński dostrzegł ten problem i uznał, że warto podjąć próbę jego rozwiązania. Narodowe Centrum Badań i Rozwoju nagrodziło jego projekt badawczy „Innowacyjny system do projektowania i weryfikacji spersonalizowanych implantów czaszkowych oparty o sztuczną inteligencję i mieszaną rzeczywistość” w konkursie LIDER. Młody naukowiec otrzymał na jego realizację grant w wysokości półtora miliona złotych.
– Innowacyjność polega na tym, że system będzie automatycznie projektował implant spersonalizowany dla danego pacjenta. Neurochirurg bezpośrednio na sali operacyjnej, klikając jeden przycisk, otrzyma gotowy model do wydruku 3D – mówi kierownik projektu o jego celach.
Dr inż. Marek Wodziński ma już na swoim koncie sukcesy związane z działalnością badawczą w branży medycznej – w ubiegłym roku otrzymał główną nagrodę w konkursie ABB za pracę doktorską pt. Metody dopasowania obrazów medycznych ukierunkowane na problem brakujących danych. Zaproponował w niej różne rodzaje algorytmów, których celem jest zwiększenie jakości zarówno diagnostyki obrazowej, jak i bezpośrednie wsparcie zabiegów medycznych. Co więcej, za swoją dotychczasową działalność został nagrodzony stypendium START Fundacji na rzecz Nauki Polskiej oraz stypendium ministra dla wybitnych młodych naukowców.
Głębsze spojrzenie przyniesie nową jakość
– Zaprojektowaliśmy już algorytmy, które są w stanie wypełnić ubytek czaszkowy. Problem polega na tym, że najczęściej sam ubytek czaszkowy nie jest tożsamy implantowi, ponieważ defekt może mieć kształt, który fizycznie nie mieści się do otworu czaszkowego – mówi dr inż. Marek Wodziński o trudnościach, które wiążą się z zaproponowaniem innowacyjnej metody zgodnej z założeniami projektu. – Bywa tak, że na skutek wypadków komunikacyjnych dany defekt powstaje poprzez uszkodzenie, a następnie złamanie i jest większy i bardziej groźny wewnątrz, niż na zewnątrz – a nie możemy włożyć czegoś od wewnątrz czaszki. Zatem przeprowadzenie implantacji wymaga dalszych modyfikacji modelu defektu. Dodatkowo, implanty są wykonywane z różnych materiałów i w zależności od materiału preferowanego przez danego neurochirurga, implant będzie miał inną odpowiedź mechaniczną i inną odpowiedź biologiczną – to też trzeba uwzględnić na etapie projektowania. Niektóre implanty będą musiały być grubsze, inne cieńsze; mocuje się je na różne sposoby. Trzeba również uwzględnić fakt, że bezpośrednio po zabiegu mózg może być zdeformowany, może się pojawić obrzęk. Implant nie powinien powodować wzrostu ciśnienia środczaszkowego, więc często powinien być trochę cieńszy niż oryginalna czaszka. Od defektu do implantu jest jeszcze jest dość daleka droga – tłumaczy naukowiec.
Dotychczasowe próby stworzenia algorytmów do projektowania implantów przez inne zespoły badawcze kończyły się umiarkowanym sukcesem. Stosowane do tej pory algorytmy nieźle radzą sobie z projektowaniem implantów do uszkodzeń podobnych do tych, które analizowały już wcześniej, ale nie są w stanie abstrahować swojej wiedzy na nowe przypadki, z którymi dotychczas nie miały styczności.
– W ramach projektu będziemy musieli jak najbardziej zwiększyć zdolność do generalizacji tych zaproponowanych algorytmów na przypadki, które nie były wcześniej w ogóle widziane w czasie procesu treningu. – mówi kierownik projektu.
 List ministra nauki z okazji Dnia Nauki Polskiej
List ministra nauki z okazji Dnia Nauki Polskiej  Spotkanie przedwyborcze z kandydatem na rektora AGH
Spotkanie przedwyborcze z kandydatem na rektora AGH