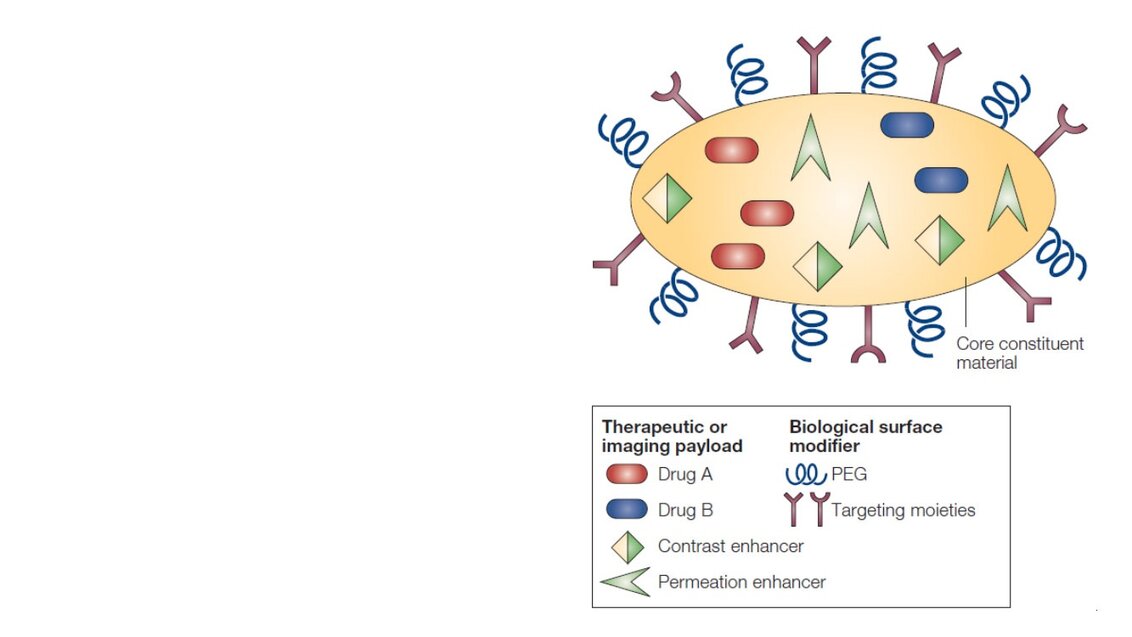
Rysunek 1. Wielofunkcyjna nanoczasteczka. Przedruk – Rysunek 1: Ferrari M. Cancer nanotechnology: opportunities and challenges. Nat Rev Cancer. 2005;5:161-71.
Choroba nowotworowa jest chorobą złożoną i obejmuje różnorodną grupę schorzeń, stanowiącą wciąż główny problem medyczny na całym świecie. Nanotechnologia – jako nauka i inżynieria władania materią na poziomie porównywalnym do rozmiaru cząsteczki biologicznej - znajduje istotne zastosowanie w medycynie, oraz niesie ze sobą potencjalną możliwość poprawy wyników klinicznych. W dziedzinie chorób nowotworowych, nanotechnologia stwarza możliwości rozwoju metod terapii oraz narzędzi pod kątem redukcji toksyczności, poprawy skuteczności i możliwości prowadzenia leczenia, a także zwiększenia wykrywalności samej choroby. Niniejsza praca opisuje najnowsze postępy w tej dziedzinie, wskazuje potencjalne możliwości na przyszłość, a także proponuje sposoby, jakimi inżynierowie i fizycy mogą przyczynić się do jej dalszego rozwoju.
Wstęp
Nowotwory są bez wątpienia najbardziej złożonymi chorobami znanymi ludzkości i jednymi z najbardziej palących problemów zdrowotnych XXI wieku. Statystki są przygnębiające - według raportu Światowej Organizacji Zdrowia (1) liczba nowo stwierdzonych przypadków chorób nowotworowych w 2012 roku wyniosła aż 14 milionów a przewidywana liczba nowych przypadków w ciagu roku wzrosnie do 22 milionow w ciagu nastepnych dwudziestu lat. W tym samym okresie przewiduje się, że liczba zgonów wzrośnie z 8,2 miliona do 13 milionów rocznie. Pomimo znacznych wysiłków, strategia leczenia raka nie zmieniła się od 30 lat - chirurgiczne usunięcie guza, toksyczna chemioterapia i/lub naświetlanie (2). W zakresie chemioterapii nastąpił pewien postęp, jednak aplikacja wielu leków w miejsce zmian nowotworowych jest nadal trudna. Problemy z zastosowaniem tych leków są często związane z ogólnoustrojową toksycznością i słabą farmakokinetyką. Wczesne zdiagnozowanie raka złośliwego nie jest łatwe i w wielu przypadkach zostaje osiągane dopiero w późnej fazie przerzutów, zmniejszając tym samych ogólną skuteczność leczenia.
W ostatnich latach nanotechnologia jawi się jako dziedzina stwarzająca możliwość w zakresie nowoczesnej diagnostyki i terapii (3-8). W jej zastosowaniu do leczenia chorób nowotworowych jawią się liczne zalety, takie jak m.in. lepsza możliwość dostarczania leków antynowotworowych do tkanek zajętych chorobą, zmniejszone efekty uboczne tj. toksyczność, oraz zupełnie nowe odmiany terapii przeciwnowotworowej, takie jak terapia fototermiczna czy też leczenie z zastosowaniem hipertermii. Badania w tym zakresie są w fazie dynamicznego rozwoju - pewna partia leków została już dopuszczona do użytku, a wiele innych nanopreparatów znajduje się obecnie w I i II fazie testów klinicznych, co wskazuje na postęp w dziedzinie nanotechnologii przeciwnowotworowej oraz sposobów jej zastosowania (8). W ten sam sposób, oparte na nanotechnologii przyrządy i metody in vitro stają się użytecznym i precyzyjnym narzędziem we wczesnej fazie diagnostyki (9-11). Potrafią one nie tylko rozpoznać charakterystyczne biomarkery z jednoczesnym określeniem ich typu, ale także mogą to zrobić równocześnie dla kilku markerów, umożliwiając tym samym wykonanie analiz dużych grup sygnatur genomicznych i proteomicznych.
Rozwój nanomateriałów
Rozwój bezpiecznych i niezawodnych nanomateriałów jest podstawą opracowania nowych terapii oraz technik obrazowania opartych na nanotechnologii. Istnieje wiele różnych systemów opartych na nanocząstkach (Rys. 1), które próbuje się wykorzystać jako potencjalne nośniki: polimery, liposomy, micele, emulsje, metale, tlenki metali, dendrymery, fulereny, kropki kwantowe i nanorurki węglowe (5, 12). Nie tylko rodzaje i typy stosowanych nanomateriałów uległy znacznemu rozwojowi. Naukowcy potrafili również dostrzec w jaki sposób można sfunkcjonalizować nanocząstki, scharakteryzować złożone, wielofunkcjonalne sprzężenia, oraz zrozumieć, co wpływa na ich biodystrybucję i toksyczność. Analiza in vitro oraz in vivo tych struktur pozwoliła na określenie ważnych tendencji w zachowaniach nanocząstek w interakcji z żywymi organizmami. Rozmiar nanocząstek, ich ładunek powierzchniowy i hydrofobowość są głównymi czynnikami wpływającymi na biozgodność i biodystrybucję. Na przykład, nanocząstka mniejsza niż 8 nm zostanie wydalona przez nerki, natomiast nanocząstki większe niż ok. 200 nm zostaną wchłonięte przez organy układu fagocytarnego, takie jak np. wątroba czy śledziona (12).
Nanocząstki mogą zostać wykorzystane do tworzenia wszechstronnych i złożonych struktur ułatwiających aplikację cząsteczek więcej niż jednego leku równocześnie, oraz do tworzenia terapii łączonych, wykonywania wielowymiarowego obrazowania, lub działania w przestrzeni teragnostycznej poprzez tworzenie cząstek jednocześnie wykazujących właściwości terapeutyczne i diagnostyczne (13). Ta wielofunkcyjność przejawia się także w nowych i bardziej skomplikowanych projektach nanosystemów reagujących na zmiany pH, temperatury lub środowiska enzymatycznego, oraz potrafiących rozpoznać zmiany fizjologiczne lub zmiany stanu choroby. Takie nanocząstki stają się bio-aktywowalne, a powyższe parametry związane z mikrośrodowiskiem nowotworu mogą zostać wykorzystane do zainicjowania procesu uwalniania leku. W analogiczny sposób zewnętrzne czynniki wyzwalające, takie jak światło lub przyłożone pole elektromagnetyczne mogą również zostać wykorzystane do aktywowania nanocząstek. Wykorzystanie zewnętrznych lub fizjologicznych czynników wyzwalających pozwoli na projektowanie bardziej złożonych struktur nanocząsteczkowych oraz kontrolowane uwalnianie leków (14, 15).
Wszystkie projekty nanocząsteczkowe muszą być szczegółowo opisane pod względem interakcji z systemami biologicznymi i organizmami żywymi tak aby rozpoznać kierunki ich toksyczności, biodystrybucji i wydalania. Obecnie w fazie rozwoju znajduje się złożony zbiór analiz i procedur in vitro do badan w hodowlach komorek oraz in vivo wykorzystywany do badań nad zwierzętami, którego celem jest standaryzacja procesów, tak aby możliwe było uzyskanie jednorodnej charakterystyki nanocząstek pochodzących z różnych laboratoriów. Procedury charakteryzacji są w dalszym ciągu poprawiane i udoskonalane w celu umożliwienia oceny bardziej zaawansowanych systemów przejawiających potencjał do wdrożenia w testach klinicznych (12,16).
Platformy terapeutyczne oparte na nanotechnologii
Dzięki enkapsulacji lub przyłączaniu współczesnych chemioterapełtyków na powierzchniach nanocząstek można przekształcić istniejące leki w nanopreparaty. Korzyści wynikające z wykorzystania nanocząstek jako nośników leków są zauważalne natychmiast (4, 5, 6). Wyjątkowe właściwości fizyczne nanocząstek (wielkość, ładunek, biokompatybilność, rozpuszczalność) mogą zostać wykorzystane do wydłużania okresu cyrkulacji nośnika, co z kolei może doprowadzić do zwiększonej akumulacji cząstek i związanego z nimi leku w obszarze nowotworowym (Rys. 2). Uważa się, że za akumulację odpowiedzialne jest zjawisko zwiększonej przenikalności i retencji (4, 17, 18). Układ naczyniowy obszaru nowotworowego rozwija się na tyle szybko, żeby wspomóc wzrost nowotworu i jest on bardziej porowaty od układu naczyniowego zdrowej tkanki. Porowatość układu naczyniowego wewnątrz nowotworu pozwala makromolekułom i nanocząstkom wniknąć do przestrzeni śródmiąższowej nowotworu. Nie zmienia to faktu, iż nasilenie zjawiska zwiększonej przenikalności i retencji różni się od siebie w przypadku różnych typów nowotworu, a już na pewno w przypadkach jednostek chorobowych u różnych pacjentów (18). W sytuacji gdy dostarczenie leku przez nanocząstki zależy wyłącznie od mechanizmu zjawiska zwiększonej przenikalności i retencji, takie nanocząsteczkowe nośniki określane są mianem celowanych 'pasywnie'. 'Aktywne' celowanie ma miejsce wtedy, gdy nośniki występują w połączeniu z ligandami celującymi, które mogą poprawić skuteczność dostarczania leków do nowotworów (5, 8). Dawki leku przypadajace na kazda nanoczastke mogą być duże ze względu na duży współczynnik powierzchni do objętości w nanoskali. Co więcej, techniki enkapsulacji leku w nanocząstkach mogą polepszyć rozpuszczalność leków hydrofobowych, eliminując w ten sposób szkodliwe rozpuszczalniki organiczne ze składu leku, chronić przed rozkładem leku in vivo, oraz osłaniać organizm pacjenta przed toksycznymi właściwościami leku jeszcze przed jego uwolnieniem w obszarze zmiany nowotworowej. Nanocząstki mogą zatem zmienić farmakokinetyczne i farmakodynamiczne parametry strukturalne, umożliwiając również odpowiednie dostosowanie charakterystyki aplikowania leku do danegto pacjenta (5). Nanocząstki mogą być także łączone w wielofunkcyjne systemy nośnikowe o właściwościach cząsteczki dopasowanych do typu nowotworu. Nanocząstki z odpowiednim ładunkiem terapeutycznym, oraz narzędziem diagnostycznym (czujnikiem obrazowania lub biochemicznym) pozwolą na monitorowanie skuteczności leczenia (5, 13).
Zalety opisane powyżej zostały już wykorzystane w kilku próbach aplikacji leku z użyciem nanocząstek. W większości tych prób, cząsteczki leków dotychczas stosowanych w chemioterapii (paklitakselu, doksorubicyny, docetakselu, metotreksatu) zostały połączone z liposomami lub nanocząstkami polimerowymi. Kilka z tych preparatów przebyło długą drogę do zatwierdzenia przez Agencję Żywności i Leków w Stanach Zjednoczonych (FDA) - najbardziej znane z nich to DOXIL® i Abraxane®. DOXIL® jest liposomowym preparatem doksorubicyny zatwierdzonym do użytku przez amerykańską Agencję Żywności i Leków w połowie lat 90. jako środek do leczenia mięsaka Kaposiego, obecnie wskazywanym jako preparat do stosowania w przypadkach opornego na leczenie raka piersi i jajnika (19). Abraxane®, oparty na albuminie preparat paklitakselu stosowany w leczeniu przerzutów złośliwego raka piersi, został dopuszczony do stosowania przez Agencję Żywności i Leków w 2005 roku (20). Preparaty oparte na albuminie pozwalają na eliminację kremoforu oraz zmniejszenie nadwrażliwości typowej dla leczenia paklitakselem. W późniejszym okresie, Marqibo (liposomowy siarczan winkrystyny) został także dopuszczony w Stanach Zjednoczonych do stosowania w przypadkach ostrej białaczki limfoblastycznej (21), natomiast NanoTherm (superparamagnetyczne nanocząstki tlenku żelaza) został dopuszczony w Europie do miejscowej ablacji w leczeniu raka mózgu - glejaka wielopostaciowego (22). Ogólnie rzecz biorąc, przejście przez nowe nanoleki drogi kończącej się na dopuszczeniu do stosowania jest procesem stosunkowo powolnym (23), choć pozytywnym aspektem jest fakt, iż obecnie kontynuowanych jest wiele testów klinicznych z wykorzystaniem platform nanocząsteczkowych jako systemów dostarczania leków.
Terapie oparte na nanocząstkach nie ograniczają się jedynie do dostarczania do organizmu cząsteczek leku. W niektórych przypadkach, nanocząstki tworzą nowe metody leczenia nowotworu, takie jak hipertermia (15) lub terapia fototermiczna (14). Nanocząstki tlenku żelaza mogą być podgrzewane w przyłożonym zmiennym polu magnetycznym, natomiast złote nanopowłoki absorbuja promieniowanie uwalniając energię w postaci ciepła. W obu przypadkach, podwyższona temperatura może pomóc w eliminacji komórek rakowych. Ważne jest również to, że ablacja termiczna może być stosowana w połączeniu z terapiami takimi jak naświetlanie i chemioterapia w celu stworzenia platform dla terapii łączonych.
Aparatura i nanocząstki stosowane w diagnostyce chorób nowotworowych
Oprócz funkcji dostarczania leku do organizmu, nanomateriały mogą być także wykorzystywane do wykrywania i diagnozowania wczesnego stadium choroby nowotworowej, oraz do monitorowania skuteczności jej leczenia. Można to osiągnąć dwoma różnymi metodami: poprzez tworzenie nowych struktur do obrazowania in vivo (24, 25), oraz za pomocą projektowania narzędzi do prób in vitro (9-11). Nanocząstki tlenku żelaza stanowią czułą, niskotoksyczną alternatywę dla standardowych odczynników kontrastowych w tradycyjnym obrazowaniu metodą rezonansu magnetycznego, takich jak wstrzykiwany gadolin. Nanocząstki znajdują także zastosowanie w technikach obrazowania przy użyciu ultradźwięków.
Bardziej złożone, warstwowe modele nanocząsteczkowe umożliwiły stworzenie struktur obrazowania wielomodalnego (26). Nowotworowa swoistość nanomateriałów celowanych może zostać wykorzystana do wyznaczenia granic pomiędzy tkankami nowotworowymi i zdrowymi, dostarczając informacji pozwalających na całkowite usunięcie tkanki nowotworowej podczas zabiegu operacyjnego. W jednej z niedawnych prób, złoty rdzeń został powleczony ramanowskimi cząstkami oznaczonymi oraz gadolinem w celu stworzenia odczynnika trójmodalnego (26). Platforma ta umożliwiła szczegółową wizualizację nowotworów i rozwijających się przerzutów w mózgu z użyciem obrazowania fotoakustycznego, ramanowskiego, oraz metodą rezonansu magnetycznego przed, w czasie i po operacji.
Diagnostyka in vitro z wykorzystaniem nanotechnologii (Rys. 3) oferuje wysoką czułość i selektywność, oraz możliwość równoczesnego wykonania pomiarów na wielu obiektach. Dobrze znane techniki produkcyjne (np. litografia) mogą zostać wykorzystane do wytwarzania zintegrowanych urządzeń przenośnych zwiększających prawdopodobieństwo użycia komercyjnego w miejscu kontaktu lekarza z pacjentem. Mechanizmy transdukcji służące do przekazywania danych mogą być oparte na efektach świetlnych (9), magnetycznych (10, 11) lub elektronicznych (27). Istnieje już kilka urządzeń zaprojektowanych do wykrywania i przechwytywania białek w celu wykonania ich pomiarów jako biomarkerów surowiczych lub tkankowych, lub w celu ich wykorzystania jako znaczniki służące do przechwycenia lub oznaczenia komórek rakowych lub pęcherzyków uwalnianych w trakcie tworzenia sie nowotworu. Takie urządzenia mają zdolność analizy dużych paneli podpisów proteomicznych, zapewniając jednocześnie wysoki stopień multipleksowania. Analiza danych może pomóc w ustaleniu związków pomiędzy różnymi poziomami biomarkerów, oraz w sporządzeniu map korelacji sygnałów sieciowych, dostarczając w ten sposób narzędzi do stworzenia rozkładu warstwowego u pacjenta w oparciu o reakcję na różne metody leczenia, oraz doprowadzić do ostatecznej poprawy skuteczności terapeutycznej. Obecnie istniejące projekty detekcyjnych platform typu in vitro mogą zostać łatwo zaadaptowane do nowych klas biomarkerów, takich jak na przykład miRNA (28).
Projekty nanocząsteczkowe w przyszłości
Im bardziej podstawowe funkcje są udoskonalane w projektach nanocząsteczkowych, tym bardziej prawdopodobne jest, że systemy wielofunkcyjne będą stawać się coraz bardziej powszechne. Teragnostyka, połączenie terapii, diagnostyki i niejednokrotnie monitorowania poterapeutycznego, stanowi obszar zainteresowań nanotechnologii (13, 29). Dzięki powstałym projektom, metaliczne i magnetyczne nanomateriały, takie jak złoto lub tlenek żelaza, pokazały, że doskonale nadają się do tego typu zastosowań - wykazują one zarówno cechy obrazowania, jak również mogą zostać wykorzystane jako nanonośniki leku.
Wraz z rozwojem bardziej złożonych nanosystemów, wydaje się oczywiste, że jest jeszcze miejsce na dalszy rozwój nanoterapii przeciwnowotworowej bez tworzenia nowych preparatów, ale z wykorzystaniem ich właściwości do rozwoju inteligentniejszych, dających odpowiedź biologiczną nanosystemów. Na przykład, w ostatnim czasie zostały opracowane nanocząstki zdolne do wzajemnej komunikacji w reakcji na aktywowanie kaskady biologicznej, wykazujące zdolność do zwiększonej kumulacji w miejscu nowotworu i jego przerzutów (30). Nie wszystkie nanosystemy przyszłości muszą jednak sięgać tak daleko. Istnieją zalety naśladowania naturalnie występujących komórek i molekuł w organizmie (np. powlekanie nanocząstek błonami komórkowymi i autopeptydami) jako sposób na przechytrzenie systemu immunologicznego i dalsza modyfikacje profilu farmakokinetycznego dostarczanego leku.(31).
W jaki sposób inżynierowie i fizycy mogą przyczynić się do dalszego postępu w tej dziedzinie?
Nanotechnologia przeciwnowotworowa jest multidyscyplinarną próbą wykorzystania wiedzy i innowacji pochodzących z kilku dyscyplin naukowych począwszy od materiałoznawstwa i fizyki, a skończywszy na biologii antynowotworowej i praktyce klinicznej (32). Pozwala ona naukowcom i badaczom z odrębnych obszarów nauki na przyczynienie się swoją zróżnicowaną wiedzą, doświadczeniem i kreatywnością do osiągnięcia ostatecznego celu jakim jest stworzenie lepszych leków lub narzędzi diagnostycznych.
Z korzyści wypływających z połączenia kilku funkcjonujących wspólnie dziedzin zrodziła się koncepcja konwergencji nauki (33). Jest to nowe podejście do nauki, współpracy i wzajemnej interakcji oparte na założeniu, że nowo tworzone idee mają większą szansę na powstanie na granicy przeplatających się dziedzin niż w przypadku dyscyplin naukowych rozwijających się w sposób indywidualny i niezależny, kiedy to zachodzące zmiany mają często charakter bardziej rozwojowy aniżeli przełomowy.
Wnioski
Od nanotechnologii oczekuje się znacznej poprawy w leczeniu i diagnostyce chorób nowotworowych (34). Wiele z tych ulepszonych rozwiązań będzie ważne, ale będzie także miało charakter stopniowy – zmniejszenie efektów ubocznych leczenia, możliwość modyfikacji dawkowania leków, oraz możliwość śledzenia efektów leczenia dzięki obrazowaniu w różnych metodach teragnostycznych. Od niektórych zastosowań oczekuje się zasadniczej poprawy terapeutycznej – na przykład przekroczenie barier biologicznych może stworzyć możliwość bardziej skutecznego leczenia choroby nowotworowej mózgu lub trzustki. To samo dotyczy aplikacji siRNA z wykorzystaniem nanocząstek w przypadku terapii genowej, co pozwala na uniknięcie rozkładu siRNA w zetknięciu z krwią pacjenta. Rowniez uzycie silnych leków, których nie można dostarczyć do organizmu w czystej postaci ze względu na ich wysoką toksyczność moze stac sie mozliwe przy uzyciu nanoczastek. Struktury do wielomodalnego obrazowania stworzą nowe możliwości monitorowania operacji chirurgicznych w czasie rzeczywistym, natomiast urządzenia do diagnostyki in vitro pozwola na zastąpienie obecnie istniejących testów dzięki ich zwiększonej czułości oraz potencjałowi do łączenia wyników wielostopniowej analizy.
Ogólnie rzecz ujmując, można spodziewać się, że dalszy postęp w tej dziedzinie będzie podążać dwoma równoległymi torami. Pierwszy z nich będzie związany z odbywającym się obecnie dostosowaniem do potrzeb środowiska klinicznego, drugi natomiast z rozwojem nowych narzędzi i technik w obszarze badań naukowych, gdzie ustawiczna innowacyjność w dziedzinie nanomateriałów doprowadzi do powstania bardziej złożonych i wielofunkcyjnych systemów nanocząsteczkowych.
dr Piotr Grodziński
Office of Cancer Nanotechnology Research
National Cancer Institute, NIH
31 Center Drive, Room 10A52
Bethesda, Maryland 20892, USA
e-mail: grodzinp(at)mail.nih.gov
Bibliografia
1. World Cancer Report 2014. IARC.
2. Mukherjee, S., The emperor of all maladies : a biography of cancer. 1st Scribner trade paperback ed2011, New York: Scribner. Xviii.
3. Ferrari M. Cancer nanotechnology: opportunities and challenges. Nat Rev Cancer. 2005;5:161-71.
4. Davis ME, Chen ZG, Shin DM. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nat Rev Drug Discov. 2008;7:771-82.
5. Kamaly N, Xiao Z, Valencia PM, Radovic-Moreno AF, Farokhzad OC. Targeted polymeric therapeutic nanoparticles: design, development and clinical translation. Chemical Society reviews 2012;41:2971-3010.
6. Duncan R, Gaspar R. Nanomedicine(s) under the microscope. Molecular pharmaceutics 2011;8:2101-41.
7. Ptak K, Farrell D, Panaro NJ, Grodzinski P, Barker AD. The NCI Alliance for Nanotechnology in Cancer: achievement and path forward. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 2010; 2:450-60.
8. Wang AZ, Langer R, Farokhzad OC. Nanoparticle delivery of cancer drugs, Annu Rev Med. 2012;63:185-98.
9. Fan R, Vermesh O, Srivastava A, Yen BK, Qin L, Ahmad H, Kwong GA, Liu CC, Gould J, Hood L, Heath JR. Integrated barcode chips for rapid, multiplexed analysis of proteins in microliter quantities of blood. Nat Biotechnol. 2008; 26:1373-8.
10. Haun JB, Castro CM, Wang R, Peterson VM, Lee H, Weissleder R et al., Micro-NMR for rapid molecular analysis of human tumor samples, Sci Transl Med. 2011;71:71ra16.
11. Osterfeld SJ, Yu H, Gaster RS, Caramuta S, Xu L, Han SJ, Hall DA, Wilson RJ, Sun S, White RL, Davis RW, Pourmand N, Wang SX. Multiplex protein assays based on real-time magnetic nanotag sensing. Proc Natl Acad Sci U S A. 2008 Dec 30;105(52):20637-40.
12. McNeil SE. Nanoparticle therapeutics: A personal perspective. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology 2009;1:264-271.
13. Yoo D, Lee JH, Shin TH, Cheon J. Theranostic magnetic nanoparticles. Acc Chem Res. 2011;44:863-74.
14. Lal S, Clare SE, Halas NJ. Nanoshell-enabled photothermal cancer therapy: impending clinical impact. Accounts of chemical research 2008;41:1842-51.
15. Toraya-Brown S, Sheen MR, Baird JR, et al. Phagocytes mediate targeting of iron oxide nanoparticles to tumors for cancer therapy. Integrative biology : quantitative biosciences from nano to macro 2013;5:159-71.
16. Crist RM, Grossman JH, Patri AK, Stern ST, Dobrovolskaia MA, Adiseshaiah PP, Clogston JD, McNeil SE. Common pitfalls in nanotechnology: lessons learned from NCI's Nanotechnology Characterization Laboratory. Integr Biol (Camb). 2013;5:66-73.
17. Matsumura Y, Maeda H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Cancer research 1986;46:6387-92.
18. Prabhakar U, Maeda H, Jain RK, et al. Challenges and Key Considerations of the Enhanced Permeability and Retention Effect for Nanomedicine Drug Delivery in Oncology. Cancer research 2013;73:2412-7.
19. Laginha KM, Verwoert S, Charrois GJR, Allen TM. Determination of doxorubicin levels in whole tumor and tumor nuclei in murine breast cancer tumors. Clinical Cancer Research 2005;11:6944-6949.
20. Sparreboom A, Scripture CD, Trieu V, Williams PJ, De T, Yang A, Beals B, Figg WD, Hawkins M, Desai N. Comparative preclinical and clinical pharmacokinetics of a cremophor-free, nanoparticle albumin-bound paclitaxel (abi-007) and paclitaxel formulated in cremophor (taxol). Clinical Cancer Research 2005;11:4136-4143.
21. Bedikian AY, Silverman JA, Papadopoulos NE, Kim KB, Hagey AE, Vardeleon A, Hwu WJ, Homsi J, Davies M, Hwu P. Pharmacokinetics and safety of Marqibo (vincristine sulfate liposomes injection) in cancer patients with impaired liver function. J Clin Pharmacol. 2011;51:1205-12.
22. http://www.magforce.de/en/studien.html
23. Venditto VJ, Szoka FC Jr. Cancer nanomedicines: so many papers and so few drugs!. Adv Drug Deliv Rev. 2013;65:80-8.
24. Tassa C, Shaw SY, Weissleder R. Dextran-coated iron oxide nanoparticles: a versatile platform for targeted molecular imaging, molecular diagnostics, and therapy. Acc Chem Res. 2011 Oct 18;44:842-52.
25. Yang L, Peng XH, Wang YA, Wang X, Cao Z, Ni C, Karna P, Zhang X, Wood WC, Gao X, Nie S, Mao H. Receptor-targeted nanoparticles for in vivo imaging of breast cancer. Clin Cancer Res. 2009;15:4722-32.
26. Kircher MF, de la Zerda A, Jokerst JV, et al. A brain tumor molecular imaging strategy using a new triple-modality MRI-photoacoustic-Raman nanoparticle. Nature Medicine 2012;18:829-34.
27. Patolsky F, Zheng G, Lieber CM. Nanowire-based biosensors. Anal Chem. 2006;78:4260-9.
28. Alhasan AH, Kim DY, Daniel WL, Watson E, Meeks JJ, Thaxton CS, Mirkin CA. Scanometric microRNA array profiling of prostate cancer markers using spherical nucleic acid-gold nanoparticle conjugates. Anal Chem. 2012;84:4153-60.
29. Cho YS, Lee GY, Sajja HK, Yang L et al. 2013. Targeted Delivery of siRNA-Generating DNA Nanocassettes Using Multifunctional Nanoparticles. Small 2013; 9:1964-73.
30. von Maltzahn G, Park JH, Lin KY, et al. Nanoparticles that communicate in vivo to amplify tumour targeting. Nature materials 2011;10:545-52.
31. Parodi A, Quattrocchi N, van de Ven AL, et al. Synthetic nanoparticles functionalized with biomimetic leukocyte membranes possess cell-like functions. Nature nanotechnology 2013;8:61-8.
32. Hull LC, Farrell D, Grodzinski P. Highlights of recent developments and trends in cancer nanotechnology research-View from NCI Alliance for Nanotechnology in Cancer. Biotechnol Adv. 2013 Aug 12
33. Sharp PA, Langer R. Research agenda. Promoting convergence in biomedical science. Science. 2011;333:527.
34. Grodzinski, P. and Farrell D. Future Opportunities in Cancer Nanotechnology - NCI Strategic Meeting Report. Cancer Res, 2014; Feb 13.
 Dr Piotr Grodziński kieruje programami w zastosowaniach nanotechnologii w biologii nowotworów i onkologii w Narodowym Instytucie Raka w Bethesda, Maryland, USA. Programy te operujące w ramach Alliance for Nanotechnology in Cancer z funduszami 150 milionów dolarów (budżet 5-letni) stworzyły multidyscyplinarne centra naukowe badające zastosowanie nanotechnologii do nowych terapii i technik diagnostycznych chorób nowotworowych.
Dr Piotr Grodziński kieruje programami w zastosowaniach nanotechnologii w biologii nowotworów i onkologii w Narodowym Instytucie Raka w Bethesda, Maryland, USA. Programy te operujące w ramach Alliance for Nanotechnology in Cancer z funduszami 150 milionów dolarów (budżet 5-letni) stworzyły multidyscyplinarne centra naukowe badające zastosowanie nanotechnologii do nowych terapii i technik diagnostycznych chorób nowotworowych.
Dr Grodziński jest absolwentem AGH i kontynuował studia w Uniwersytecie Południowej Kalifornii w Los Angeles, gdzie zajmował się cienkimi warstwami półprzewodnikowymi dla zastosowań w optoelektronice. Prace w tej dziedzinie kontynuował w ośrodku badawczym Motoroli w Arizonie. Pod koniec lat 90. zainteresował się biotechnologią i nanotechnologią i stworzył dużą grupę badawczą związaną z systemami mikrofluidowymi dla zastosowań w analizie genetycznej w Motoroli. System integracji tych urządzeń stworzonych w laboratorium w Motoroli był jednym z najbardziej zaawansowanych w tym okresie. W 2002 r. dr Grodziński przeniósł się do Los Alamos National Laboratory, gdzie kierował grupą badawczą w Departamencie Nauk Biologicznych i okresowo pełnił funkcje Chief Scientist w tamtejszym Centrum Nanotechnologii.
Dr Grodziński otrzymał doktorat z inżynierii materiałowej na Uniwersytecie Południowej Kalifornii w Los Angeles w 1992 roku; jest autorem 17 patentów, 60 publikacji i 10 rozdziałów w książkach. Ostatnio, dr Grodziński został wybrany Fellow Amerykańskiego Instytutu Inżynierii Zastosowań Medycznych i Biologicznych (AIMBE).
 Jak podbijamy nanoświat – AGH NAUKA spotkania (nr 25)
Jak podbijamy nanoświat – AGH NAUKA spotkania (nr 25)  Jak samodzielnie wynieść 1000 worków śmieci z lasów? | Bunkier Nauki odc. 48
Jak samodzielnie wynieść 1000 worków śmieci z lasów? | Bunkier Nauki odc. 48  Obalamy MITY na temat sieci 5G – czy jest się czego bać? | Bunkier Nauki odc. 47
Obalamy MITY na temat sieci 5G – czy jest się czego bać? | Bunkier Nauki odc. 47  Świat w dobie AI – AGH NAUKA spotkania (nr 24)
Świat w dobie AI – AGH NAUKA spotkania (nr 24)  Projekty dotyczące zaawansowanych materiałów dla energetyki finansowane przez sieć M-ERA.NET 3
Projekty dotyczące zaawansowanych materiałów dla energetyki finansowane przez sieć M-ERA.NET 3  Spotkanie przedwyborcze z kandydatem na rektora AGH
Spotkanie przedwyborcze z kandydatem na rektora AGH  Brąz dla pływaków na AMP
Brąz dla pływaków na AMP  Góry też mogą być smart. Uczony z AGH rozwija inteligentny system wspomagania ratownictwa górskiego
Góry też mogą być smart. Uczony z AGH rozwija inteligentny system wspomagania ratownictwa górskiego